摘要:截至2023年12月31日,中国药品监督管理局医疗器械审评中心(CDE)总计收到了2781份创新医疗器械申请,共250款医疗器械已获NMPA批准上市,占比约9.02%。中国创新医疗器械领域整体呈现出显著增长势头。
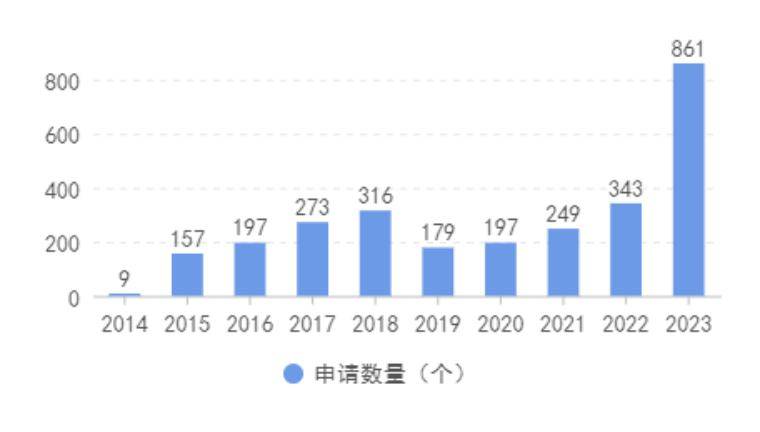
自《创新医疗器械特别审批程序》发布以来,截至2023年12月31日,NMPA收到创新医疗器械特别审批申请项数共计2781个,其中近三年收到创新医疗器械特别审批申请项数共计1453个,占比约52%;2023年1月-12月收到创新医疗器械特别审批申请项数共计861个,占比约31%,较2022年同比增长151%,超1.5倍。
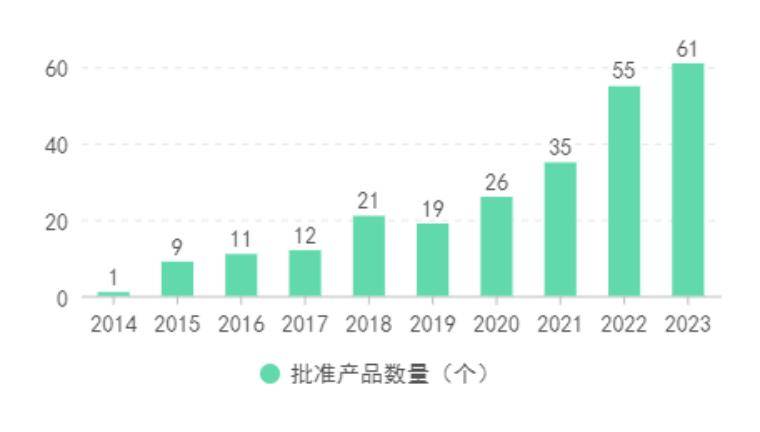
自2014年12月10日,深圳华因康基因科技有限公司第一个创新医疗器械产品批准以来,截至2023年12月31日,共250个创新产品获得注册批准证(国产226个,进口24个),每年批准产品数量呈上升趋势。其中,2023年,国家药监局批准了61个创新医疗器械上市(名单见附表),较2022年国家药监局已批准上市的创新医疗器械项数55个增加了6个,同比增长10.91%,涵盖了高值耗材、医用设备、IVD试剂,涉及美敦力、华科精准、联影医疗、腾讯医疗等企业,并且多个产品为国内甚至全球首创产品。
从治疗领域来看,17个创新医疗器械为心血管相关产品;3个创新医疗器械为眼科相关产品;8个创新医疗器械为骨科相关产品;2个创新医疗器械为诊断试剂;此外还有糖尿病、血透等相关医用软件以及胶原蛋白溶液等产品。
从产品分布来看,226个国产创新医疗器械高度集中,传统产业大省创新医疗器械数量排名靠前五,分别是北京63个、上海42个、广东36个、江苏34个、浙江20个,博乐体育top5省市获批数量占比高达86%。进口产品涉及美国、韩国、加拿大、以色列4个国家,其中美国最多,达到13个。
创新医疗器械方面,广州累计13个产品进入国家创新医疗器械审批通道,4个获批上市,数量位居广东省第二,其中2023年,广州市共计2个产品进入国家创新医疗器械审批通道,数量创新高。
创新医疗器械的获批数量增加,表明整个医疗器械行业正处于一个较为活跃的发展阶段,而创新成果逐渐得到认可和推广,也更有助于提升医疗水平和服务质量。近年来,广州高端医疗器械企业创新日益活跃,细分领域取得重大突破,创新医疗器械行业整体呈现出良性发展态势,但相比北京、上海、深圳仍有差距。

2014年2月7日,国家食品药品监督管理总局(现名“国家药品监督管理局”)发布了《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号),自2014年3月1日起施行。该程序是在确保上市产品安全、有效的前提下,针对创新医疗器械设置的审批通道(该审批简称:“创新特别审批”)。
近年来,NMPA深入推进医疗器械审评审批制度改革,加速医疗器械创新发展。对于进入创新医疗器械审评审批通道的产品,NMPA通过早期介入、专人负责、多次沟通、专家咨询等方式开展科学审评审批,在“标准不降低、程序不减少”的前提下,对创新医疗器械予以特别通道办理。据统计,对创新优先平均审评审批时间较其他普通三类首次注册产品平均压缩83天,创新产品从研发到上市的时间进一步缩短。博乐体育2018年11月,NMPA发布了新修订的《创新医疗器械特别审查程序》。修订后的程序设置更科学合理,有利于进一步集中力量,提高效率,促进医疗器械产业创新发展。
 博乐体育
博乐体育
